Sumala sa paagi sa pagkonektar sa amino acid ug asukar, ang sugar peptide mahimong bahinon sa upat ka mga kategoriya: O glycosylation, C a N glycosylation, dew saccharification ug GPI (glycophosphatidlyinositol) connection.
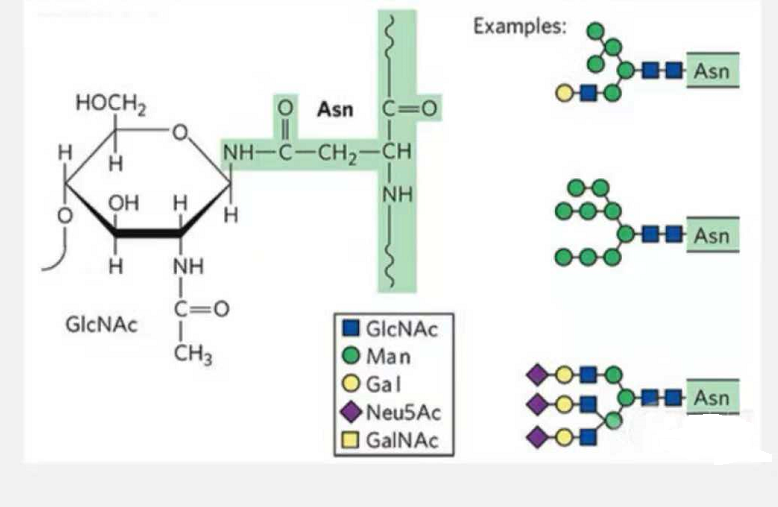
1. Ang N-glycosylation glycopeptides gilangkuban sa N-acetamide glucose sa pagkunhod sa tumoy sa glycan chain (Glc-Nac) nga nalambigit sa N atom sa amide nga grupo sa side chain sa pipila nga Asn sa peptide chain, ug ang Asn nga makahimo sa pagsumpay sa kadena sa glycan kinahanglang mahimutang sa AsN-X-Ser /Thr (X! =P) sa motif nga naporma sa mga salin.Ang asukal kay N-acetylglucosamine.
Ang N-glycosylation nga giusab nga structural glycopeptide
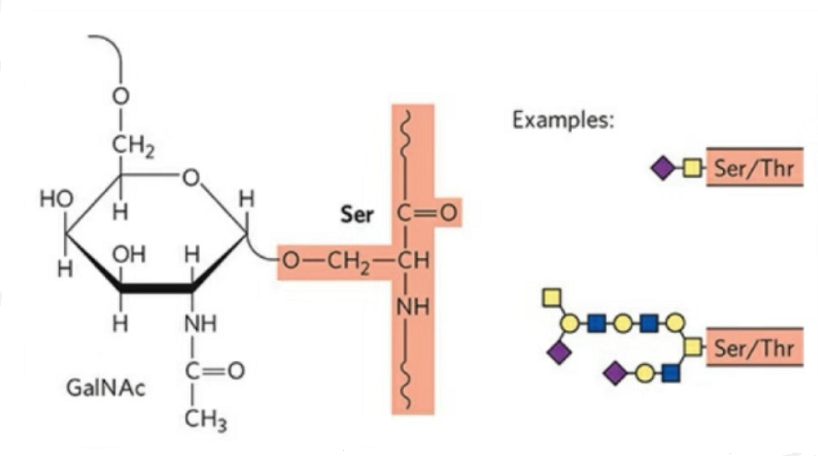
2. Ang istruktura sa O-glycosylation mas simple kay sa N-glycosylation.Kini nga glycopeptide kasagaran mas mubo kaysa glycan, apan adunay daghang mga tipo kaysa N-glycosylation.Ang Ser ug Thr sa kasagaran mahimong glycosylated sa peptide chain.Dugang pa, adunay mga glycopeptides nga gidekorasyonan sa tyrosine, hydroxyl, ug hydroxyproline glycosylation.Ang posisyon sa link mao ang hydroxyl oxygen atom sa kilid nga kadena sa nahabilin.Ang gisumpay nga mga asukal mao ang galactose o N-acetylgalactosamine (Gal&GalNAc) o glucose/glucosamine (Glc/GlcNAc), mannose/mannosamine (Man/ManNAc), ug uban pa.
Ang O-glycosylation nagbag-o sa istruktura
3. Glycopeptide O-GlcNAC glycosylation ((N-acetylcysteine (NAC)) (glcnAcN-acetylglucosamine/acetylglucosamine)
Ang usa ka N-acetylglucosamine (GlcNAc) glycosylation nagkonektar sa mga protina nga O-GlcNAc sa hydroxyl oxygen atom sa serine o threonine nga nahabilin sa usa ka protina.O-GlcNA glycosylation mao ang O-GlcNAc monosaccharide dayandayan nga walay glycan extension;Sama sa peptide phosphorylation, ang O-GlcNAc glycosylation sa glycopeptides usa usab ka dinamikong proseso sa dekorasyon nga protina.Ang dili normal nga dekorasyon sa O-GlcNAc mahimong hinungdan sa lainlaing mga sakit sama sa diabetes, sakit sa cardiovascular, tumor, sakit nga Alzheimer ug uban pa.
Glycosylation nga mga punto sa glycopeptides
Ang sukaranan nga mga istruktura sa polypeptide ug mga kadena sa asukal gisumpay sa mga kadena sa protina pinaagi sa mga covalent bond, ug ang mga site nga nagsumpay sa mga kadena sa asukal gitawag nga mga site nga glycosylation.Tungod kay walay template nga mosunod sa biosynthesis sa glycopeptide sugar chains, lain-laing mga sugar chain ang idugtong sa samang glycosylation site, nga mosangpot sa gitawag nga microscopic inhomogeneity.
Glycosylation sa glycopeptides
1. Epekto sa glycopeptide glycosylation sa therapy-kaepektibo sa therapeutic nga mga protina
Sa kaso sa therapy-therapeutic nga mga protina, ang glycosylation makaapekto usab sa katunga sa kinabuhi ug pag-target sa mga tambal nga protina sa vivo.
2. Matunaw nga glycopeptide glycosylation ug mga protina
Gipakita sa mga pagtuon nga ang mga kadena sa asukal sa ibabaw sa mga protina makapauswag sa pagkatunaw sa molekula sa mga protina
3. Glycopeptide glycosylation ug immunogenicity sa protina
Sa usa ka bahin, ang mga kadena sa asukal sa nawong sa mga protina mahimo’g mag-aghat sa piho nga mga tubag sa resistensya.Sa laing bahin, ang mga kadena sa asukal makatabon sa pipila ka mga ibabaw sa nawong sa protina ug makapakunhod sa immunogenicity niini
4. Glycopeptide glycosylation nga nagdugang sa kalig-on sa protina
Ang glycosylation makapadugang sa kalig-on sa mga protina sa lain-laing mga kondisyon sa denaturation (sama sa mga denaturant, kainit, ug uban pa) ug malikayan ang pagtipon sa mga protina.Sa parehas nga oras, ang mga kadena sa asukal sa nawong sa mga protina mahimo usab nga magtabon sa pipila nga mga punto sa pagkadaot sa proteolytic sa mga molekula sa protina, sa ingon nagdugang ang resistensya sa mga protina sa mga protina.
5. Glycopeptide glycosylation nga makaapekto sa biological nga kalihokan sa mga molekula sa protina
Ang pagbag-o sa glycosylation sa protina makapahimo usab sa mga molekula sa protina sa pagporma og bag-ong biolohikal nga mga kalihokan
Oras sa pag-post: Ago-03-2023